Bénéficiez de l'expérience de nos experts en R&D clinique pour choisir la bonne stratégie clinique.…

Dispositif médical
L’évaluation clinique portant sur les dispositifs médicaux est une nécessité en vertu du règlement sur les dispositifs médicaux (UE) 2017/745 (MDR).
Notre expérience des exigences cliniques et réglementaires propres aux investigations cliniques des dispositifs médicaux et de diagnostic in-vitro vous garantissent un accompagnement fiable dans la conception, la mise en œuvre et la gestion du plan d’investigation clinique de votre dispositif médical (avant et après commercialisation).
DE LA CONCEPTION A LA COMMERCIALISATION DE
NOUVEAU DISPOSITIF MÉDICAL (DM OU DM DIV),
LE PARCOURS PEUT ÊTRE FLOU ET COMPLEXE
Les réglementations et les exigences varient selon les pays, le niveau de risque, les caractéristiques du produit et son utilisation.


Dotée d’une vaste expérience et culture dans tous les types de dispositifs médicaux, notre équipe d’experts DM comprend :
- des chefs de projet
- des attachés de recherche clinique
- des data managers
- des biostatisticiens
- des experts en réglementation et en assurance qualité
- des rédacteurs médicaux
Nos experts peuvent vous accompagner
- dans la conception, la mise en œuvre et la gestion de tout ou partie de votre plan d’investigation clinique (étude pilote/preuve de concept, étude confirmatoire, étude PMCF/SCAC “suivi clinique après commercialisation”),
- quel que soit le type de dispositif médical (DM, DMDIV, dispositif combiné (DM + médicament), DM connecté, logiciel en tant que DM),
- que votre objectif soit d’étayer une soumission réglementaire avant la mise sur le marché (c.-à-d. un dossier de marquage CE par un Organisme Notifié), d’obtenir le remboursement du produit ou de surveiller l’utilisation du produit après sa mise sur le marché.
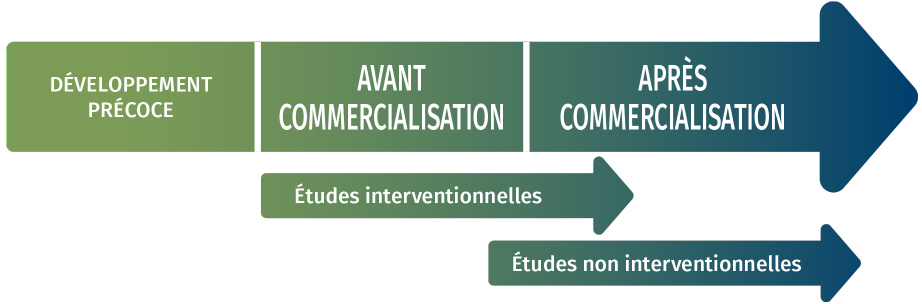
ÉTUDES interventionnelles
- Etudes pilotes
- Etudes confirmatoires (Pre- et Post-AMM)
- Etudes PASS (Innovation Post-Authorisation Safety Studies)
ÉTUDES NON INTERVENTIONNELLES
- Études de suivi clinique après commercialisation (SCAC/PMCF)
- Registres après la commercialisation
- Évaluations économiques de la santé
- Rapports de matériovigilance
- Études centrées sur le patient
- Base de données des systèmes de santé
- Analyses (SNDS…)
NOS SERVICES
conseil en DÉVELOPPEMENT CLINIQUE DU DM
- Revue de la littérature
- Stratégie clinique et réglementaire
- Conception et validation des investigations
- Classification des produits et des risques
- Études de faisabilité précoces
- Gestion des risques
INVESTIGATIONS AVANT/APRÈS LA MISE SUR LE MARCHÉ
- Conception et rédaction médicale
- Soumissions réglementaires
- Suivi clinique
- Gestion des investigations cliniques
- Biométrie et sciences des données
- Matériovigilance et PSUR
- Rapports d’études cliniques
Notre expérience couvre l’évaluation des dispositifs médicaux, DMDIV, DM “combiné”, et DM “logiciel” utilisés pour de nombreuses indications dans un large éventail de domaines thérapeutiques
L’ÉQUIPE ICTA SPÉCIALISÉE DANS LA CONCEPTION ET GESTION D’ÉTUDES EN VIE RÉELLE PEUT ÉGALEMENT VOUS AIDER À CONCEVOIR :
DES ÉTUDES AVANT COMMERCIALISATION
pour vous permettre de mieux appréhender l’utilisation du dispositif médical dans un cadre clinique plus large et prendre les bonnes décisions réglementaires
DES ÉTUDES APRÈS COMMERCIALISATION
pour l’extension du marquage CE et assurer la surveillance après commercialisation (études en vie réelle).
Quel que soit le stade de développement de votre dispositif médical, l’équipe ICTA vous apporte sa vision, ses compétences et son savoir-faire pour vous aider à :
Mieux comprendre le marché et identifier la bonne stratégie pour votre dispositif médical
Mettre en place un plan d’investigation global pertinent pour votre dispositif médical
Évaluer la sécurité et les performances de votre dispositif médical, et collecter les données nécessaires à son marquage CE
Réduire les risques et assurer la conformité de votre dispositif médical avec les réglementations et les exigences ISO.
AUTRES DOMAINES D’EXPERTISE